Accueil > Nos actions > Journal de Bord des Opérations > Analyse de l'influence des facteurs anthropiques et climatiques sur le corail Acropora muricata et ses zooxanthelles symbiotiques, sur le platier récifal de la Saline (île de La Réunion)
Introduction
Bien que ne couvrant que 0,1% de la surface de la Terre (Spalding & Grenfell 1997), les récifs coralliens sont parmi les écosystèmes les plus riches du monde vivant hébergeant 25% de l’ensemble des espèces marines (Roberts 2003), dont près de 30% des espèces marines de poissons et 10% des espèces de poissons consommés par l’Homme (Smith 1978). Cependant, au cours du siècle dernier leur déclin est observé de par le monde avec une perte de 19% des récifs coralliens. 15% des récifs restants risquent de disparaître dans les 10 à 20 prochaines années et 20% de plus sont menacés de l’être dans 20 à 40 ans. Ce déclin est lié au piétinement, au lessivage des sols (dû à la déforestation sur le bassin versant), à un apport massif de nutriments et produits chimiques, à la surpêche en synergie avec le changement global (Wilkinson 2008).
Le Journal de Bord

- Massif corallien de l’île de La Réunion
Les coraux bio-constructeurs de récifs vivent en endosymbiose avec des micro-algues dinobiontes photosynthétiques, les zooxanthelles (Stanley 2006). Leur activité photosynthétique permet de transformer l’énergie lumineuse en énergie chimique. Environ 95% du carbone organique assimilable va être transféré des zooxanthelles vers le corail ce qui contribue sensiblement aux besoins en carbone et en énergie de ce dernier (Trench 1993 ; Yellowlees, Rees & Leggat 2008). Les zooxanthelles sont donc les seuls producteurs d’énergie des coraux autotrophes (Coles & Brown 2003 ; Brown & Dunne 2008). Pour leur part, les zooxanthelles se situant dans l’endoderme du corail vont bénéficier d’une protection face aux prédateurs extérieurs, et reçoivent principalement du dioxyde de carbone, CO2 (aq), des lipides et de l’ammonium, NH4+ (Yellowlees, Rees & Leggat 2008) produit par leur hôte.
De nombreux facteurs abiotiques influencent l’état de santé des coraux. L’augmentation des rejets liés à une activité humaine croissante sur le littoral conduit à un enrichissement en éléments nutritifs, en matières particulaires et aussi en contaminants chimiques (Cuet 1989 ; Grigg & Dollar 1990). Son rôle dans les cycles biogéochimiques du carbone (Yates & Halley 2006), de l’azote (Cuet et al. 2011) et du phosphore n’est pas à négliger. Ainsi, le récif de Saint-Gilles - La Saline doit faire face depuis une trentaine d’années à une perturbation anthropique croissante (Conand et al. 2007) qui se traduit par un enrichissement en éléments nutritifs des eaux récifales par résurgences d’eaux douces conduisant parfois à des états d’eutrophisation (Cuet et al. 1988 ; Naim, Cuet & Mangar2000). Les éléments nutritifs (e.g. ammonium, nitrates, phosphates) présents dans l’eau de mer ont des effets sur la croissance corallienne très controversés.
La densité des zooxanthelles présentes dans les coraux dépend très fortement des conditions environnementales (Manzello 2010). Ainsi, l’hydrodynamisme permet de faire diminuer le stress oxydatif subi par les tissus coralliens et permet un meilleur rendement photosynthétique des zooxanthelles et donc une meilleure croissance de leur hôte (Finelli et al. 2006).
De plus, les apports d’eau douce, modifient la composition de l’eau de mer. En période de crue une augmentation de la charge sédimentaire apportée par les rivières est observée. Les rivières, le long de leur bassin versant, vont récupérer toute sorte de pollutions avant d’atteindre le lagon auquel elle les transmet (Wilkinson 2008).
L’augmentation de la température de l’eau de mer accompagnée d’un fort éclairement, est une des causes principales du blanchissement des coraux (Conand et al. 2007 ; Wooldridge & Done 2009). C’est aujourd’hui la principale menace pour la survie des récifs coralliens dans les prochaines décennies (Glynn 1993 ; Berkelmans 2002 ; Hoegh-Guldberg et al. 2007). Le blanchissement est dû à la rupture de l’endosymbiose entre le corail et les zooxanthelles (Wooldridge & Done 2009). Une hausse de 1 à 3°C au-dessus du seuil optimal de température, est suffisante pour faire diminuer considérablement le taux de calcification et donc la croissance corallienne. La majorité des espèces de coraux possèdent un optimum de calcification proche de 27°C (Clausen & Roth 1975 ; Jokiel & Coles 1977).
L’objectif de l’étude est d’analyser l’influence des facteurs environnementaux et climatiques sur l’activité photosynthétique d’Acropora muricata sur le récif de la Saline où des apports élevés en sels nutritifs par des résurgences de la nappe phréatique sont connus (Chauvin 2008). Elle s’intègre aux travaux de doctorat d’Anne Chauvin (commencé en 2009, ECOMAR) sur le sujet « changement global et calcification en milieu récifal : analyse des interactions climatiques et anthropiques à l’échelle de l’écosystème et des organismes constructeurs des récifs, les coraux ». La période d’échantillonnage des données que nous analysons s’étale sur une année, avec des prélèvements et des mesures trimestriels.
Y a-t-il une relation entre la teneur en sels nutritifs et l’activité photosynthétique, la densité des zooxanthelles symbiotiques et les teneurs en chlorophylle ? Quelle est l’influence de la température de l’eau de mer et de l’éclairement ?
Matériel et méthodes
Matériel d’étude : L’espèce Acropora muricata (Linnaeus, 1758) fait

- Branche d’Acropora muricata
partie de l’embranchement des Cnidaires, de la classe des Anthozoaires, de l’ordre des Scléractiniaires. Elle possède un squelette branchu et constitue l’un des constructeurs les plus importants des platiers récifaux de la Réunion (Bruggemann et al. 2008). A. muricata est retrouvée depuis la sub-surface jusqu’à -20 m de profondeur (Faure 1982). Elle est l’une des premières espèces présentes à la Réunion à blanchir en cas d’anomalie positive de température (Guillaume et al. 2010). Ses capacités d’adaptation aux perturbations climatiques et anthropiques font l’objet d’une attention particulière (Guérin et al. 2007, 2008 ; Denis et al. 2011).
Les zooxanthelles, symbiontes des coraux, appartiennent actuellement à la classe des Dinobiontes. Elles furent dans un premier temps décrites comme une seule et même espèce : Symbiodinium microadriaticum (Freudenthal, 1962). Des analyses morphologiques, cytologiques, biochimiques, physiologiques (Schoenberg & Trench 1980 ; Blank & Trench 1985) puis génétiques (Rowan & Powers 1991) ont ensuite révélé leur diversité. Neuf clades classés de A à I ont alors été déterminés (Pochon et al. 2006 ; LaJeunesse et al. 2010 ; Pochon & Gates 2010). Les coraux scléractiniaires sont principalement associés aux clades A, B, C, D (Baker 2003). Le clade C qui permet une croissance optimale, est retrouvé chez Acropora sp. (Pochon et al. 2001). Sur les platiers récifaux réunionnais, Denis (2010) a montré la présence de zooxanthelles de type C2 et C3 aux propriétés thermosensibles chez Acropora muricata. Quelques espèces coralliennes des platiers réunionnais arborent le clade D (zooxanthelles thermotolérantes), (Guérin et al. 2007, 2008).
Localisation du site d’étude : Le site est localisé sur un récif corallien de
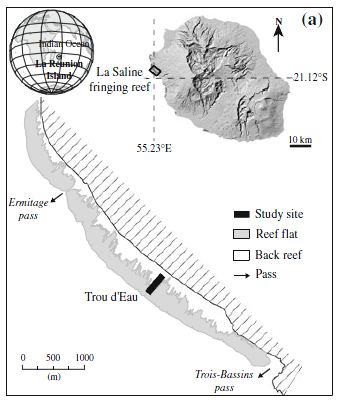
- Situation du site d’étude de Trou d’Eau du récif frangeant de St Gilles/La Saline (Cuet et al. 2011)
la Saline, sur la côte ouest de l’île de la Réunion au lieu-dit « Trou d’Eau » (latitude 21°05 S, longitude 55°14 E), zone présentant de fortes résurgences d’eau douce (Chauvin 2008). L’île est soumise à un climat tropical avec alternance d’une saison chaude et humide (janvier à mi-mai) et d’une saison fraîche et sèche (juillet à mi-octobre) intercalées par des intersaisons de refroidissement puis de réchauffement (Denis et al. 2011). Six stations le long d’une radiale perpendiculaire à la plage échelonnées de la dépression d’arrière récif (DAR) jusqu’au platier récifal ont été mises en place (20m, 50m, 80m, 110m, 200m, 300m).
Activité photosynthétique des zooxanthelles : Le fluorimètre PAM (Pulse Amplitude Modulation ; Schreiber & Bilger 1993),

- Un fluorimètre PAM
permet de mesurer le taux de transport d’électrons (ETR) à travers les photosystèmes quantifiant l’état de santé du corail par l’analyse de l’efficacité photosynthétique maximale (Ralph, Larkum & Kühl 2005). Les paramètres que nous allons utiliser renseignent directement sur les processus photosynthétiques en cours dans les zooxanthelles (Ralph, Larkum & Kühl 2005). Ils sont calculés à l’aide des courbes ETR/Eclairement :
![]() le taux de transport d’électrons maximal ETRmax, obtenue après adaptation pendant une heure à l’obscurité, traduit l’activité photosynthétique maximale en condition de lumière saturante.
le taux de transport d’électrons maximal ETRmax, obtenue après adaptation pendant une heure à l’obscurité, traduit l’activité photosynthétique maximale en condition de lumière saturante.
![]() la valeur de l’éclairement saturant Ek (indice d’acclimatation), est obtenue par l’intersection de la droite de la pente initiale et d’ETRmax. Une diminution d’Ek traduit une acclimatation aux faibles intensités lumineuses, et inversement une augmentation d’Ek traduit une acclimatation aux fortes intensités lumineuses.
la valeur de l’éclairement saturant Ek (indice d’acclimatation), est obtenue par l’intersection de la droite de la pente initiale et d’ETRmax. Une diminution d’Ek traduit une acclimatation aux faibles intensités lumineuses, et inversement une augmentation d’Ek traduit une acclimatation aux fortes intensités lumineuses.
![]() l’efficacité photosynthétique maximale Fv/Fm est directement obtenue par le fluorimètre. Elle s’obtient en divisant Fv, la fluorescence variable, par Fm, la fluorescence maximale, et indique la capacité photochimique potentielle c’est-à-dire l’efficacité photosynthétique maximale du photosystème II. Ce rapport est aussi appelé le yield.
l’efficacité photosynthétique maximale Fv/Fm est directement obtenue par le fluorimètre. Elle s’obtient en divisant Fv, la fluorescence variable, par Fm, la fluorescence maximale, et indique la capacité photochimique potentielle c’est-à-dire l’efficacité photosynthétique maximale du photosystème II. Ce rapport est aussi appelé le yield.
Analyse des tissus coralliens : Les tissus des polypes sont extraits à l’aide d’un jet d’eau de mer filtrée en circuit fermé avec un Waterpik®, (Johannes & Wiebe 1970). La branche de corail est placée dans le fond de la cuve où de l’eau de mer filtrée (EDMF) est ajoutée. L’extraction se termine lorsque la branche est entièrement blanche, ainsi les tissus sont correctement extraits.
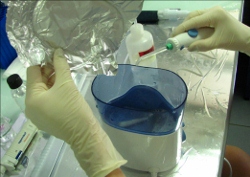
- Extraction des tissus coralliens à l’aide d’un Waterpick®
Facteurs abiotiques : Des prélèvements d’eau de mer ont été effectués trois jours consécutifs à marée basse pour chacune des campagnes et stations de prélèvement. L’eau de mer a été filtrée par un filtre Whatmann GF/F (47 mm). L’ammonium a été analysé selon la méthode de Koroleff (1969) décrite par Aminot (1983). Les densités optiques ont été mesurées avec un spectrophotomètre (Kontron Uvikon 922), au moyen de cuves de 100 mm de trajet optique.
La salinité a été mesurée par conductivité à l’aide d’une sonde multi paramètres YSI 556MPS.
Un enregistrement en continu de la température de l’eau de mer a été assuré toutes les heures par un enregistreur placé in situ sur le platier à environ 50 m le 7 juillet 2010 (Hobo Water Temp Pro, précision 0,2 °C, Onset Computer Corporation, Pocasset, USA).
Des relevés d’irradiance ont été acquis par l’intermédiaire de la station de Météo France de la pointe de Trois-Bassins.
Discussion
Température et irradiance : Aux périodes de l’année où l’irradiance et la température de l’eau de mer sont les plus faibles, la densité de zooxanthelles, la concentration en Chlorophylle a et l’efficacité photosynthétique maximales (Fv/Fm) ont les plus fortes valeurs (Stimson 1997 ; Brown et al. 1999 ; Fagoonee et al. 1999 ; Fitt et al. 2000, Warner et al. 2002).
Le profil de la courbe de température de surface de l’eau de mer (SST) obtenu dans cette étude est le même que celui observé par Denis et al. (2011) lors de leur étude réalisée à Trou d’Eau pendant l’année 2007-2008.
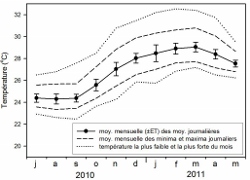
- Moyenne mensuelle de la température de l’eau de mer enregistrée in situ à 50 m de la plage entre juillet 2010 et mai 2011
Les même SST minimales sont retrouvées en septembre, mais un décalage des SST maximales est observé. En effet, le mois de mars a été le mois le plus chaud de l’été 2011 alors que les SST les plus fortes étaient retrouvées en janvier 2008. Ces variations inter-annuelles peuvent modifier le temps de réponses des coraux aux changements climatiques subit. Une étude répétée sur plusieurs années, sur plusieurs sites, pourrait permettre de mieux cerner l’impact de ces variations, spatiales et inter-annuelles sur Acropora muricata dans les récifs corallien de la Réunion.
Par ailleurs, les prélèvements réalisés en mars montrent une concentration en chlorophylle a faible malgré une importante densité de zooxanthelles.
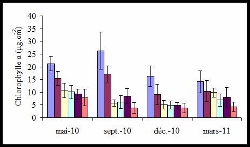
- Concentration en Chlorophylle a des branches coralliennes en fonction des campagnes de prélèvement pour chaque station (20 m, 50 m, 80 m, 110 m, 200 m et 300 m respectivement)
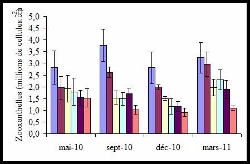
- Quantité de zooxanthelles des branches coralliennes en fonction des campagnes de prélèvement pour chaque station (20 m, 50 m, 80 m, 110 m, 200 m et 300 m respectivement)
Cela pourrait être expliqué par une division accrue de celles-ci augmentant leur nombre pour une même quantité de chlorophylle. Cette forte division des zooxanthelles pourrait exprimer un stress du corail annonçant un début de blanchissement (Ladrière et al. 2008). Cela peut être associé aux données d’efficacité photosynthétique, Fv/Fm, qui nous indique l’état de santé du corail (Denis 2010). Il a des valeurs significativement plus faibles pour la campagne de mars, ce qui montrerait un retard de la réponse corallienne aux facteurs climatiques.
Impact de la nappe phréatique : L’enrichissement du milieu en éléments nutritifs (e.g. azote, phosphore, nitrate, nitrite, ammonium) a pour effet d’augmenter la densité de zooxanthelles et/ou la concentration en chlorophylle a (Stambler et al. 1991 ; Stimson & Kinzie 1991 ; Marubini & Davies 1996). Les résultats obtenus pour la concentration en NH4+ de l’eau de mer en mai montrent une diminution progressive de cette concentration en s’éloignant de la côte avec un maximum pour les stations situées à 20 m et 50 m.
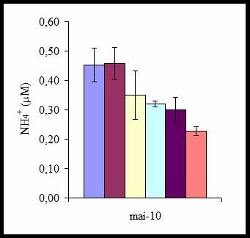
- Concentration en ammonium de l’eau de mer en fonction des campagnes de prélèvements pour chaque station
Ces résultats sont en accord avec les observations de Chauvin (2008) et Pierret (2008) qui montrent dans leurs études que les teneurs en phosphates et en nitrates évoluent de la même manière avec la distance à la plage.
Fagoonee et al. (1999) ont montré que la variabilité de l’environnement et l’activité anthropique influencent toutes deux la densité de zooxanthelles in situ chez A. muricata. Il est donc vraisemblable que la densité de zooxanthelles et la teneur en chlorophylle a, plus élevées sur les stations de 20 m et 50 m, soient liées à l’enrichissement en éléments nutritifs de la DAR.
Conclusion
Les boutures d’Acropora muricata présentent de fortes différences dans leurs caractéristiques physiologiques et leurs performances métaboliques en fonction des stations et des saisons de prélèvements. Les coraux dans les zones enrichies en éléments nutritifs par l’influence terrigène (20 m et 50 m) présentent, en accord avec la littérature, une augmentation de la densité de zooxanthelles et de la concentration en chlorophylle a. Ces apports terrigènes montrent donc un effet positif sur A. muricata mais ces résultats doivent être pris avec précaution. Les communautés algales sont en compétition avec les espèces coralliennes présentes dans le récif. Une perturbation (tempêtes, cyclones, …) pourrait donner l’avantage aux algues qui ayant une meilleur capacité de résilience étouffent les coraux (Fabricius et al. 2005). Cela mettrait donc à plus ou moins long terme le récif en danger.
De plus on peut émettre l’hypothèse qu’il peut également y avoir des apports de produits phytosanitaires lors de la percolation des eaux de la nappe phréatique puisqu’elles sont alimentées par les ravines en amont qui bordent des champs cultivés (Jones & Kerswell 2003 ; Jones et al. 2003 ; Jones 2005 ; Richard 2006). Dans les récifs réunionnais des activités enzymatiques anormales similaires à des empoisonnements aux herbicides ont déjà été retrouvées dans les holothuries (Kolasinski et al. 2011). Une étude plus poussée de la composition de l’eau de mer sur les stations proches de la plage pourrait amener des réponses à ce sujet.
La crise actuelle que traversent les récifs est très certainement le résultat d’interactions complexes entre les stress anthropiques et les stress liés aux changements climatiques globaux (Knowlton 2001).
Cependant, à La Saline, l’activité photosynthétique des coraux demeure élevée sur les sites enrichis en éléments nutritifs pour les saisons chaudes et humides. De plus, ils subissent de plus grandes variations de température de surface par rapport aux sites sous influence océanique. Une adaptation des colonies coralliennes situées près de la plage aux variations des facteurs abiotiques s’est peut être mise en place. On peut donc se demander si les apports terrigènes ne permettraient pas d’atténuer l’impact du changement global sur ces stations. Chauvin et al. (2011) ont déjà montré que l’impact de l’acidification des océans, également liée aux émissions de CO2 dans l’atmosphère, est moins important au niveau de la DAR qu’au niveau du platier récifal pour Acropora muricata.



